Senin, 07 November 2016
Selasa, 04 Oktober 2016
Senyawa Ester yang terdapat pada Buah-buahan,Bunga, dan Parfum
TUGAS III
Ester adalah senyawa kimia yang sering digunakan dan dijumpai dalam kehidupan sehari - hari khususnya para industri makanan dan minuman, pada senyawa ester ini memiliki beberapa kelebihan diantaranya adalah memiliki aroma atau bau yang khas aroma yang ada pada ester kebanyakan adalah aroma buah - buahan yang setiap harinya banyak kita jumpai disekitar kita.berikut adalah turunan senyawa ester yang memiliki aroma buah - buahan, bunga, dan parfum
1. Aprikot
Ester yang terkandung dalam buah Aprikot adalah Ethyl Heptanoate
2. Raspberry
Ester yang terkandung dalam Raspberry adalah Isobutil Format
3. Pir
Ester yang terkandung dalam buah pir adalah Propylethanoate
4. Feijoa
Ester yang terdapat dalam buah Feijoa adalah Methyl Benzoate
5. Blackberry
Ester yang terdapat pada buah Blackberry adalah Propylhexanoate
6. Kenanga
Ester yang terdapat pada Bunga Kenanga adalah Metilbenzoate
7. Pelargonium
Ester yang terdapat pada bunga Pelargonium adalah Geranylacetate
8. Melati
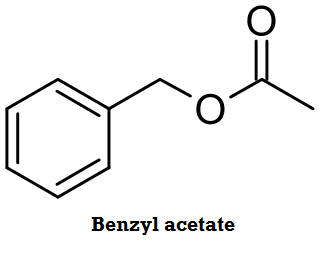
Ester yang terdapat pada bunga melati adalah benzyl acetate
9. Rose
Ester yang terdapat pada bunga Rose adalah Metylpentanoate
10. Lavender
Ester yang terdapat pada bunga Lavender adalah Linalyl acetate
11. Parfum Gardenia
Ester yang terkandung dalam parfum Gradenia adalah Methyl phenylacetate
12. Parfum Floral
Ester yang terkandung dalam parfum Floral adalah Benzyl acetate
Senin, 29 Agustus 2016
Kamis, 28 Juli 2016
Tugas
TUGAS I
SOAL
ESSAY
1.
Jelaskan
definisi bebeapa istilah berikut ini :
a) Gugus Fungsi
Gugus fungsi merupakan bagian aktif dari senyawa karbon yang menentukan sifat-sifat senyawa karbon.
b) Ikatan kovalen nonpolar
Ikatan kovalen nonpolar adalah ikatan yang terbentuk ketika atom membagikan elektronnya secara merata
c) Elektronegatifitas
Elektronegatifitas adalah kemampuan atom umtuk menarik elektron luarnya atau elektron valensi
2. Tuliskan 6 golongan molekul
penyusun makhluk hidup sebagai bagian pembahasan dalam kimia organik !a) Gugus Fungsi
Gugus fungsi merupakan bagian aktif dari senyawa karbon yang menentukan sifat-sifat senyawa karbon.
b) Ikatan kovalen nonpolar
Ikatan kovalen nonpolar adalah ikatan yang terbentuk ketika atom membagikan elektronnya secara merata
c) Elektronegatifitas
Elektronegatifitas adalah kemampuan atom umtuk menarik elektron luarnya atau elektron valensi
6 golongan molekul penyusun makhluk hidup yaitu :
- air
- protein
- vitamin
- mineral
- lemak
- kabohidrat
3. Buktikan jenis ikatan (ionik/kovalen) yang dimiliki dari senyawa berikut ini :
a) Natrium Iodida
p = 11 ; n=12 ; e=11
1s2 2s2 2p6 3s1 elektron terluar 1, sehingga untuk stabil Na cenderung melepaskan 1 elektron
sehingga menjadi Na+
p=53 ; n=74 ; e=53
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 elekton terluarnya 7 sehingga agar stabil iod cenderung menarik 1 elektron sehingga menjadi I-
Jika natrium dan iodida membuat ikatan maka ikatan cenderung stabil jika natrium melepaskan 1 elektron ke iodida, sehingga Na bermuatan positif satu (+1) dan iodida bermuatan negatif satu(-1) ketika kedua unsur ini berikatan akan membentuk natrium iodida (NaI) dan ikatan yang terbentuk adalah ikatan ionik
b) Amoniak
p=7 ; n=7 ; e= 7
1s2 2s2 2p3 elektron terluar 5 agar stabil Nitrogen membutuhkan 3 elektron
p=1 ; n=1 ; e=1
1s1 elektron teluar 1 untuk stabil membutuhkan 1 eleltron
pada ikatan amoniak terjalin pemakain elektron bersama anatara tiga atom hidrogen dan satu atom nitrogen dan akan terbentuk ikatan kovalen.
c) Metanol
p=6 ; n=6 ; e=6
1s2 2s2 2p2 elektron terluar 4 untuk stabil membutuhkan 4 elektron
p=1 ; n=1 ; e=1
1s1 elektron teluar 1 untuk stabil membutuhkan 1 eleltron
p=8 ; n=8 ; e=8
1s2 2s2 2p4 elektron terluar 6 untuk stabil oxygen membutuhkan 2 elektron
Pada ikatan dalam senyawa metanol terjadi pemakaian bersama elektron bebas atom karbon,atom hidrogen, dan atom oksigen ikatan yang terbentuk adalah ikatan kovalen d) Magnesium Oksida
p = 12 ; n = 12 ; e = 12
1s2 2s2 2p6 3s2 elektron terluar 2 untuk stabil Mg melepaskan 2 elekton sehingga bemuatan positif dua (Mg++)
p=8 ; n=8 ; e=8
1s2 2s2 2p4 elektron terluar 6 untuk stabil oxygen membutuhkan 2 elektron
Jika magnesium dan oksigen membentuk ikatan akan cenderung stabil apabila magnesium memberikan 2 elektronnya kepada oksigen sehingga magnesium bermuatan postife dua dan oksigen sebagai penerima elektron memiliki muatan negatife 2 dan ketika kedua unsur ini berikatan akan membentuk magnesium oksida, ikatan yang terbentuk adalah ikatan ionik.
4. Berikan penjelasan jenis ikatan yang dimiliki apakah kovalen polar atau kovalen nonpolar dari molekul berikut ini :
a) asetaldehid
senyawa
asteldehid merupakan senyawa kovalen polar dikarenakan memiliki gugus karbonil
yang terdiri dari atom C dan O dimana Atom C mempunyai keelektronegatifan kecil
sedangkan atom O memiliki keelektronegatifan besar
b) Etana
senyawa etana adalah senyawa kovalen non polar dikarenakan ikatan yang terbentuk pada atom H dan atom C mempunyai keelokronegatifitas rendah, elektron tertarik sama kuat.
c) Etanol
Senyawa etanol merupakan
senyawa kovalen polar dikarenakan memiliki gugus alkil yang bersifat nonpolar
yang terdiri dari atom C dan atom H yang keeloktronegatifitasnya kecil dan juga
memiliki gugus hidroksil yang sifatnya polar karena atom O dan atom H mempunyai
keeloktronegatifitas besar, tapi kepolarannya sangat dipengaruhi oleh gugus
hidroksil dikarenakan gugus alkil pendek pada senyawa ini.
d) Iodium (I2)
Senyawa iodium adalah senyawa kovalen non polar karena terdiri dari atom yang sama sehingga jika berkaitan cenderung tertarik sama kuat.